Mecânica Respiratória
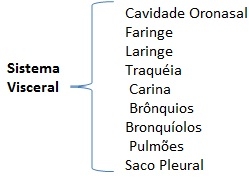
O sistema respiratório é formado pelo sistema visceral que é composto por:
Esta estrutura é composta por uma membrana que reveste mais intimamente a superfície interna da cavidade torácica (pleura parietal) e por outra que envolve os pulmões (pleura visceral); a pleura é uma estrutura similar a um balão cheio de líquido, que sofre um processo de invaginação em um dos pólos, formando uma dupla camada membranosa preenchida por um fluido chamado líquido intrapleural. Este líquido pleural constitui uma área de pressão negativa, graças à drenagem hídrica constante pelo sistema linfático. A pressão pleural situa-se, em repouso, em torno de 3 ou 4 mm Hg negativos e tem como função garantir a adesão por sucção do pulmão à parede torácica através da dupla membrana, de modo que qualquer movimento do segundo é acompanhado pelo primeiro. Quando ocorre perfuração pleural, há a entrada de ar, decorrente da pressão negativa, e este acúmulo de gás atmosférico (pneumotórax) comprime os tecidos pulmonares e eventualmente o coração. Isto também pode decorrer da ruptura da pleura visceral, por um aumento na pressão pulmonar, transferindo ar dos alvéolos para a área de menor pressão.
O sistema ósseo associado ao sistema respiratório é representado pelas costelas, esterno, coluna vertebral, clavícula e escápulas que, em conjunto, delimitam anatomicamente o espaço ventilatório, formando a caixa torácica. O sistema muscular compreende o diafragma, intercostais externos, escalenos, serráteis anteriores e esternocleidomastoideos, enquanto musculatura inspiratória; os intercostais internos e os abdominais são fundamentais para a expiração contra resistência ou acelerada.
O diafragma possui uma perfuração central por onde passa o plexo vasculonervoso para a região inferior do corpo. Os pulmões são inflados e esvaziados devido aos movimentos do diafragma, que alteram a dimensão céfalo-caudal da caixa torácica; este músculo atua como o principal motor primária da inspiração, sendo o único ativado em situação de repouso. Outra causa da expansão pulmonar é a elevação do gradil costal que é gerado pela contração dos intercostais externos, esternocleidomastoideos e outros músculos. Quando a ventilação se encontra em nível basal, praticamente todo o trabalho ventilatório é realizado durante a inspiração. Este trabalho pode ser dividido em 3 parcelas: a necessária para expandir os pulmões e a caixa torácica, vencendo a resistência elástica dos tecidos, chamado trabalho ligado ao trabalho elástico; a exigida para superar e viscosidade dos pulmões e da caixa torácica, denominado trabalho ligado à resistência dos tecidos; e a requerida para sobrepujar a resistência das vias aéreas durante a movimentação do ar, chamado trabalho ligado à resistência das vias aéreas. A quantidade de energia convertida em trabalho é maior na realização da 1ª etapa.
Quando ocorre um aumento na demanda ventilatória passa-se a realizar também trabalho expiratório. Doenças pulmonares restritivas, como a fibrose cística, geram aumento no trabalho ligado à compliância e à resistência dos tecidos, enquanto alterações obstrutivas, como a asma, incrementam os valores do trabalho ligado à resistência das vias aéreas. Havendo ou não trabalho expiratório, cria-se, durante a fase de expiração, uma pressão maior contra a superfície pulmonar, diretamente relacionada à redução do volume, e que viabiliza a saída do ar para a atmosfera. A movimentação do ar é resultado de diferentes pressões geradas graças às contrações musculares e aos subseqüentes aumentos e reduções nas dimensões torácicas e pulmonares.

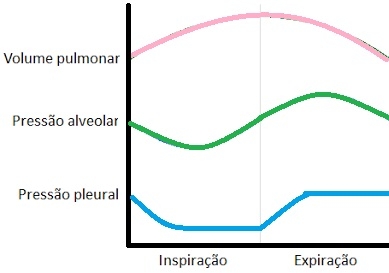
A diferença entre a pressão das pleura é chamada pressão transpulmonar, variável diretamente afetada pelas forças elásticas que atuam sobre os pulmões. Para qualquer grau de expansão pulmonar, a pressão transpulmonar tende a levar o pulmão ao colapso. À medida em que a inspiração transcorre, o volume torácico e pulmonar aumentam, a pressão pleural torna-se mais negativa, causando a queda da pressão alveolar e a migração do ar para dentro dos pulmões levando à expansão da caixa torácica e a redução da pressão pleural. O valor da pressão pleural, antes em – 4 mm Hg, migra para – 8 ou – 10 mm Hg, e a relação de proximidade anatômica entre pleura e pulmão gera a transferência imediata da queda de pressão para o ambiente alveolar, de modo que a pressão alveolar também cai, provocando um desequilíbrio pressórico entre o compartimento intrapulmonar e o atmosférico de forma que o ar do meio externo penetre nos pulmões. À medida em que o ar entra, tanto o volume pulmonar quanto a pressão alveolar aumentam, e o próprio aumento de pressão encerra o influxo de ar. No momento em que a pressão alveolar se iguala ao seu valor inicial, o movimento expiratório começa. O relaxamento da musculatura inspiratória, associado à retração elástica dos tecidos pulmonares e torácicos, gera a diminuição do volume e o subseqüente aumento da pressão pleural, imediatamente transmitida para os alvéolos, causando elevação da pressão alveolar, que supera a atmosférica. Quando o ar migra para o meio externo, o volume e a própria pressão alveolar começam a declinar. Quando restabelecido o valor inicial da pressão, encerra-se o movimento expiratório e reinicia-se o inspiratório.
O grau de expansão que os pulmões experimentam para cada unidade de aumento de pressão é chamado compliância pulmonar. As forças que atuam sobre os pulmões podem ser divididas em dois grupos: as forças elásticas dos tecidos pulmonares, determinadas pela resistência oferecida pelas fibras elásticas e colágenas do tecido conjuntivo pulmonar ¾ ou parênquima pulmonar ¾ aos movimentos de expansão do órgão respiratório e que atuam mais efetivamente quando os tecidos pulmonares estão alongados em relação à sua dimensão inicial; e as forças causadas pela tensão superficial do líquido que reveste a superfície interna da parede dos alvéolos. Em todos os espaços aéreos pulmonares, há a geração de uma força elástica de tendência contrátil sobre os pulmões, favorecendo o colapso alveolar. Esta força elástica pode ser minimizada devido à ação do hormônio surfactante que é uma mistura de fosfolipídeos, proteínas e íons cálcio, secretada pelas células epiteliais alveolares do tipo II e reduz a tensão superficial da interface entre ar e líquido que atua na superfície pulmonar. As moléculas de fosfolipídeos são as responsáveis pela redução da tensão superficial, pelas suas características elétricas e sua afinidade diferencial por água: enquanto a porção fosfatada se dissolve em meio aquoso, a porção lipídica volta-se para o meio gasoso. Pode-se dizer que o surfactante é importante para provocar a redução da pressão transpulmonar necessária para a manutenção da expansão dos pulmões. Recém nascidos prematuros de baixo peso ainda não secretam surfactante adequadamente, o que aumenta a pressão de colapso sobre os alvéolos causando a “síndrome da angústia respiratória do recém nascido”, porque o tamanho. Para insuflar o sistema respiratório, a pressão necessária é quase o dobro da exigida para preencher os mesmos pulmões após sua remoção da caixa torácica, e a produção de trabalho, bem como o dispêndio energético também aumentam. Assim, a compliância das estruturas integradas é quase a metade do valor da compliância dos pulmões isolados. Além disto, é a caixa torácica que limita os movimentos de contração e expansão extremas dos pulmões.
Volumes e Capacidades Pulmonares: Estas grandezas podem ser mensuradas através de espirometria, utilizando-se o espirômetro.
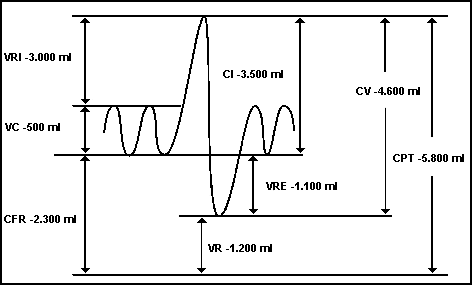
Volume corrente:volume de ar inspirado e expirado em cada ciclo ventilatório normal, (mais ou menos 500 ml).
Volume de reserva inspiratória: é o volume de ar que ainda pode ser inspirado após a inspiração do volume corrente ( cerca de 3 litros de gás).
Volume de reserva expiratória: é o volume de ar ( cerca de 1 litro) que pode ser exalado ao final da expiração do volume corrente normal.
Volume residual: ar que permanece nos pulmões mesmo ao fim da mais vigorosa das expirações (aproximadamente 1200 ml ).
Na descrição dos eventos do ciclo ventilatório, é importante considerar dois ou mais volumes associados, que são chamados capacidades pulmonares.
Capacidade inspiratória: soma do volume corrente com o volume de reserva inspiratória.
Capacidade residual funcional: soma do volume de reserva expiratória e do volume residual.
Capacidade vital: soma do volume de reserva inspiratória, volume corrente e volume de reserva expiratória, e corresponde à máxima quantidade de ar que pode ser expelido dos pulmões após uma inspiração máxima.
Capacidade pulmonar total= soma de todos os volumes e corresponde ao maior volume que os pulmões podem alcançar ao final do maior esforço inspiratório possível.
Volume expirado forçado 1 (VEF1): intensidade com que o ar pode ser expirado em 1 segundo, realizado através do teste espirométrico. Aonde o paciente sopra dentro de um bocal, após a realização da inspiração máxima, empregando a maior força expiratória possível. A curva que representa esta medida é sempre a mesma (inclinação inicial acentuada, seguida da tendência à estabilização e o platô). Esta curva representa o comportamento do volume expirado ao longo do tempo, bem como o seu valor total. O platô representa a capacidade vital, expressa em litros. O intervalo de tempo mais importante está entre 0 e 1 segundo, por permitir o cálculo do VEF1. Enquanto a medida da capacidade vital relaciona-se ao armazenamento de gases, o volume expirado forçado 1 representa a capacidade de liberar os gases respirados. O fator tempo também deve ser levado em consideração para a determinação de outras medidas. A quantidade total de ar que se movimenta pelas vias aéreas a cada minuto é chamado volume minuto da ventilação e corresponde ao volume corrente multiplicado pela freqüência ventilatória. Em condições basais, o volume corrente é cerca de 500 ml, e a freqüência ventilatória é de 12 ciclos por minuto, perfazendo um total de 6 L/min de ar ventilado em condições de repouso.
A finalidade da ventilação é a renovação do ar nas áreas de trocas gasosas dos pulmões, onde há grande densidade capilar e a intensidade da renovação desta região é chamada ventilação alveolar. Durante a ventilação basal, , o volume corrente é suficiente para o preenchimento das vias respiratórias até os bronquíolos terminais. Depois, a curta distância a ser percorrida até alcançar os alvéolos é superada por difusão, o que acarreta no movimento altamente veloz das moléculas gasosas entre as demais moléculas orgânicas. Nem todas as vias aéreas são áreas de troca gasosa. As vias onde não ocorre hematose são chamadas de espaço morto, enquanto o ar que as preenche é o ar do espaço morto ( volume corresponde a 150 mililitros). Na expiração, o ar do espaço morto é exalado antes do ar alveolar. Assim, o espaço morto não é útil para a remoção dos gases respiratórios dos pulmões. Em presença de disfunção alveolar, alguns alvéolos podem ser considerados como espaço morto. Quando este espaço morto alveolar é incluído na mensuração total do espaço morto, obtém-se o espaço morto fisiológico. Em condições de saúde, o espaço morto fisiológico equivale ao o espaço morto anatômico. Quando há doença instalada, o valor do primeiro pode superar o valor do segundo. O volume de ar que permanece dentro do sistema respiratório, evitando o colabamento dos alvéolos relaciona-se ao espaço morto fisiológico. O espaço morto anatômico é formado por estruturas não colabáveis. O conhecimento destes diferenciais morfofisiológicos permite que se enuncie o conceito de ventilação alveolar por minuto. Dentro de parâmetros de normalidade, a capacidade vital é normal e o volume expirado forçado 1 também.
Na estrutura alveolar, os compartimentos são separados uns dos outros por septos interalveolares;o a alcatrão inalado através do cigarro invade o espaço alveolar, deposita-se sobre o septo e destrói sua estrutura tecidual, de modo que há fusão entre alvéolos, formando um macroalvéolo. Quando aplicado na pele de ratos, o alcatrão causa câncer em 24 horas. O cigarro apresenta a estrutura de um destilador, em que a brasa, no momento da tragada, alcança os 3000°C. Temperaturas desta magnitude vaporizam os corpos com os quais entram em contato; após esta vaporização, as partículas são lançadas para dentro da cavidade oronasal, que funciona como um tubo de resfriamento, onde há condensação e destilação ao longo das vias aéreas. O principal fator etiológico da destruição alveolar, no entanto, é o alcatrão. Os macroalvéolos formados a partir da ruptura dos septos possuem uma menor área para a ocorrência da hematose e para o armazenamento de gases respiratórios, provocando uma diminuição na capacidade vital. Doenças com estas características são classificadas como restritivas, pois há perda funcional e aumento no volume do espaço morto fisiológico. A poluição atmosférica também é fator etiológico de doenças respiratórias e pulmonares restritivas. Todos os fumantes são portadores de enfisema, inclusive os fumantes passivos, embora em menor grau. Os sintomas e os sinais clínicos de insuficiência respiratória comumente não se manifestam, já que o organismo é capaz de manejar um certo grau de perda funcional. Além das respostas fisiopatológicas induzidas pelo fumo sobre a capacidade alveolar, o cigarro exerce outros efeitos ao longo das vias respiratórias. O movimento ciliar do epitélio de revestimento é paralisado por 1 ou 2 horas, a cada vez que o indivíduo fuma, fundamentalmente pela ação da nicotina. A paralisação da atividade dos cílios dificulta sobremaneira a remoção da camada de muco que se deposita gradualmente sobre as paredes internas das vias aéreas. Esse muco se acumula, juntamente com a fase particulada do ar ventilado, até causar a obstrução parcial da ventilação. A partir deste momento, o fumante passa a tentar, voluntariamente, a remoção da secreção mucóide, através do que chama-se popularmente de “escarro” ou “pigarro”. O tabagismo crônico pode induzir a destruição definitiva do epitélio ciliado especializado.
A fibrose cística, bem como edemas pulmonares, são outros exemplos de alterações de natureza restritiva. Se a capacidade vital estiver íntegra, mas o volume expirado forçado em 1 segundo estiver reduzido, a alteração é dita obstrutiva, sendo a asma e a bronquite os exemplos mais comuns. Quando ambas as variáveis analisadas estão comprometidas, o diagnóstico é doença pulmonar obstrutiva crônica (DPOC) que evoluiu para um processo de fibrose dos tecidos pulmonares; esta doença, uma vez superada sua fase inicial meramente obstrutiva, acarreta menor complacência pulmonar e, portanto, menor influxo aéreo, diminuindo a capacidade vital. Existem parâmetros para a determinação e classificação das doenças broncopulmonares enquanto restritivas ou obstrutivas. Após a determinação da capacidade vital, confronta-se o valor encontrado com o valor previsto para aquele indivíduo, calculado a partir da média populacional, considerando o sexo, a idade e a estatura. Divide-se, então, a capacidade vital encontrada pela capacidade vital prevista. O ponto de corte para a normalidade é 0.7, ou seja, o indivíduo tem de manter sua capacidade vital íntegra em 70%, no mínimo, para ser considerado dentro de parâmetros de normalidade quanto às doenças restritivas. Para permitir a verificação da saúde das vias aéreas, realiza-se a determinação do VEF1, através de um teste espirométrico, aonde calcla-se a razão entre o valor encontrado para o VEF1 e a capacidade vital, sendo a faixa de normalidade considerada até 0.7, ou seja, o indivíduo deve ser capaz de expirar 70% de sua CV em 1 minuto, para ser classificado como saudável no que se refere às doenças obstrutivas.
A asma é uma alteração respiratória obstrutiva que envolve um broncoespasmo induzido por agentes alergênicos sobre um indivíduo hiperreativo. Histologicamente, o brônquio apresenta uma estrutura cartilaginosa periférica, recoberta e entremeada por tecido muscular liso; sobre a musculatura lisa, encontra-se tecido conjuntivo propriamente dito, dando sustentação ao epitélio de revestimento ciliado. Existem também, associadas a estes estruturas, as células produtoras de muco. Cabe a esta secreção mucóide a função de adesão das inúmeras partículas que invadem as vias aéreas juntamente com o ar inalado ¾ poeira, pêlos de animais, ácaros, fumaça, fuligem, carbono em suspensão. A ação direta dos agentes alergênicos sobre as células da mucosa brônquica induz uma reação inflamatória, com a subseqüente liberação de histamina, que atua localmente sobre a musculatura lisa, causando contração e, broncoespasmo. Os portadores de asma desenvolvem uma hiperreatividade brônquica, provocando broncoespasmo e hiperconstrição exacerbados, aumentando sobremaneira a resistência ao fluxo de ar. Indivíduos normais, quando aspiram grandes quantidades de agentes alergênicos, também induzem o broncoespasmo; a diferença básica entre a reação do indivíduo normal e do portador de asma é a magnitude da resposta do asmático, que é muito mais exacerbada, ou seja, o broncoespasmo é muito mais intenso. A respiração sibilante decorre da dificuldade do ar em deixar o espaço morto. Os principais efeitos da asma não são os danos decorrentes da dificuldade respiratória sobre a disponibilidade de oxigênio aos tecidos, já que as crises alérgicas mais comuns não duram mais do que 10 minutos, e a obstrução não é completa. O dano mais importante é a elevação da pressão alveolar e intratorácica durante a fase expiratória ¾ a dificuldade do asmático, durante a crise, não é a inalação do ar, mas a expiração. Em decorrência deste aumento de pressão, a médio e longo prazo, pode ocorrer deformação de ossatura torácica, sobretudo em criança, acarretando protrusão do esterno, gerando “tórax ou peito em quilha” ou “peito de pombo”, bem como protrusão das costelas, causando a ocorrência do tórax em barril.
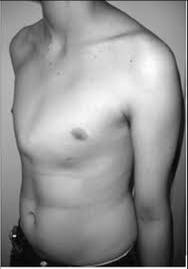
Tórax em quilha de navio.
Estas são as alterações típicas do quadro de asma. O tratamento consiste na administração de drogas broncodilatadoras, que agem através do bloqueio da ação da histamina ou através de ação simpatomimética, causando o relaxamento da musculatura brônquica. Esta última droga gera efeitos cardiovasculares, podendo gerar uma resposta taquicárdica importante, bem como aumento na pressão arterial. Estes efeitos são maiores quando o medicamento é administrado através das bombas para aspiração. Em alguns casos, pode ser desencadeado o quadro de AIE (asma induzida por exercício), esta indução decorre do aumento na demanda ventilatória e da exposição aumentada a agentes alergênicos (poeira, pólen, tintas, solventes, fuligem, fumaça , ar frio, ar seco, ácaro, fungos, mofo). O exercício expõe o portador de asma a uma maior incidência crônica de agentes alérgicos sobre a mucosa brônquica. Existem testes para detecção de asma induzida por exercício. O protocolo consiste no registro da curva espirométrica prévia à atividade, seguido de um exercício de carga progressiva até 75 ou 80% da freqüência cardíaca máxima prevista. Terminado o exercício, registra-se novamente a curva espirométrica 1, 3, 5, 7, 10 e 15 minutos após o exercício. Quando a criança faz asma induzida por exercício, a inclinação da curva decai a cada nova medida, o que significa que o VEF1 está gradativamente mais reduzido, embora a capacidade vital esteja mantida. Durante a crise asmática, a concentração de histaminas aumenta, em resposta ao agente alergênico, e o broncoespasmo é induzido; decorridos alguns minutos, a atuação da histamina é reduzida, e o broncoespasmo cede. São raríssimas as crises de longa duração, ou seja, 20 ou 30 minutos. Neste caso, leva-se o indivíduo asmático para o hospital. Após a crise aguda de asma, surge um período refratário que perdura por aproximadamente uma a duas horas. Mesmo que estimulada, não há o desencadeamento de uma nova crise, pois as células da mucosa desenvolvem uma resistência transitória ao agente alergênico. Se uma destas crises for desencadeada durante a sessão de treinamento, interrompe-se a atividade e coloca-se o indivíduo sentado, com o tronco projetado para a frente e com os cotovelos apoiados, para permitir a movimentação livre do esterno, costelas e diafragma. Esta posição é chamada (posição de ancoramento). Frente ao treinamento genérico regular, a mucosa respiratória tende a responder menos , e a freqüência e intensidade das crises tendem a diminuir.
A natação é uma ótima atividade para indivíduos que sofrem de crises alérgicas, pois o ar é úmido e aquecido, e partículas como pólen, pêlos e poeira não estão presentes. O único agente alergênico da piscina é o cloro; raramente, no entanto, surgem indivíduos cloro sensíveis. A posição horizontal de sustentação dentro da água facilita a respiração, por melhorar a movimentação das costelas. Além disto, o principal motivo da indicação da natação como treinamento para asmático é a necessidade de um maior controle respiratório, pois a expiração é realizada contra resistência, o que induz o fortalecimento dos músculos expiratórios. Portanto, a natação reduz a intensidade do quadro por um mecanismo diferente, condições ambientais favoráveis e reforço de musculatura expiratória. A asma não impossibilita o desempenho esportivo.
